Quando se fala em solubilidade, é comum a afirmação “semelhante dissolve semelhante”. Ou seja, uma substância polar tende a se dissolver num solvente polar e uma substância apolar tende a se dissolver em um solvente apolar.
Sendo assim, fica mais fácil entender por que muitas substâncias inorgânicas, como os sais e os ácidos, que são polares dissolvem-se na água que é um solvente polar, como por exemplo, água e álcool. Já as substâncias orgânicas que, geralmente, são apolares dissolvem-se em solventes orgânicos também apolares; por exemplo, (é possível dissolver a parafina na gasolina, a gasolina no querosene, mas o mesmo não acontece se o solvente for a água). O mesmo acontece com óleo e água, que não se misturam.
Saturação de uma solução
Quando adicionamos sal comum à água gradativamente em temperatura constante e agitada continuamente, é possível observar que, em dado momento, não ocorrerá a dissolução do sal, utilizando como exemplo o NaCl (Sal de Cozinha). Isso ocorrerá quando houver aproximadamente 360 g de sal para cada litro de água. A partir desse ponto, dizemos que a solução tornou-se saturada ou que a solução atingiu o seu ponto de saturação, pois qualquer quantidade de sal que for adicionada ao sistema irá precipitar ou formar corpo de fundo.
O ponto de saturação depende do soluto (O que se é dissolvido), do solvente (Quem dissolve) e das condições físicas (sólidos líquido ou gases) a temperatura sempre influi e a pressão, em especial, em soluções que contêm gases).Este ponto é definido pelo coeficiente ou grau de solubilidade.
Coeficiente de Solubilidade
O Coeficiente de Solubilidade é a quantidade necessária de uma substância para saturar uma quantidade padrão de solvente, em determinada temperatura e pressão.
Por exemplo, os coeficientes de solubilidade em água a 0ºC:
- Para o NaCl é igual a 357g/L
- Para o CaSO4 é igual a 2 g/L
- Para o CaSO
Quando o coeficiente de solubilidade de uma substância em um determinado solvente possui valor próximo de zero, ou seja, praticamente nulo, dizemos que a substância é insolúvel nesse solvente. Um exemplo é o AgCl, cujo coeficiente de solubilidade em água é 0,014 g/L. Quando se trata de dois líquidos, podemos dizer que são imiscíveis, é o caso da água e óleo.
Em função do ponto de saturação, podemos classificar as soluções em:
- Insaturadas: são aquelas que contêm menos soluto e mais solvente (aguado)
- Saturadas: são aquelas que atingiram o grau de solubilidade. Está no limite da saturação; (concentrada)
- Supersaturadas: ultrapassam o coeficiente de solubilidade. (´´melada``)
- Saturadas: são aquelas que atingiram o grau de solubilidade. Está no limite da saturação; (concentrada)
- Supersaturadas: ultrapassam o coeficiente de solubilidade. (´´melada``)
 Esquema do aumento de massa de soluto em uma quantidade fixa de solventefonte:Slideplayer.com
Esquema do aumento de massa de soluto em uma quantidade fixa de solventefonte:Slideplayer.com
Observando a representação gráfica, é possível notar que o ponto de saturação representa um limite de estabilidade de uma solução. Por consequência, as soluções supersaturadas só existem em condições especiais e, quando ocorrem, são sempre instáveis.
CURVA DE SOLUBILIDADE
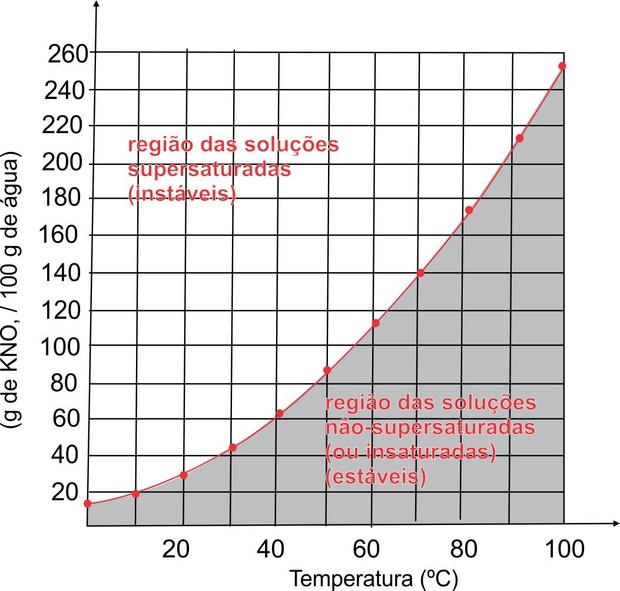 Curva de Solubilidade do KNO3:
Curva de Solubilidade do KNO3:
CURVA DE SOLUBILIDADE
Curvas de solubilidade são os gráficos que apresentam a variação dos coeficientes de solubilidade em função da temperatura. A tabela abaixo representa os coeficientes de solubilidade do KNO3 /100g. Desses dados, resultou a curva de solubilidade representada.
Solubilidade do KNO3 em água
| Temperatura (°C) | (g) KNO3 /100g de água |
| 0 | 13,3 |
| 10 | 20,9 |
| 20 | 31,6 |
| 30 | 45,8 |
| 40 | 63,9 |
| 50 | 85,5 |
| 60 | 110 |
| 70 | 138 |
| 80 | 169 |
| 90 | 202 |
| 100 | 246 |
 Curva de Solubilidade do KNO3:
Curva de Solubilidade do KNO3:
- Para qualquer ponto em cima da curva de solubilidade, a solução é saturada.
- Para qualquer ponto acima da curva de solubilidade, a solução é supersaturada.
- Para qualquer ponto abaixo da curva de solubilidade, a solução é insaturada.
- Para qualquer ponto acima da curva de solubilidade, a solução é supersaturada.
- Para qualquer ponto abaixo da curva de solubilidade, a solução é insaturada.
Solubilidade de gases em líquidos
Os gases, em geral, são pouco solúveis em líquidos. Sua solubilidade depende consideravelmente da pressão e da temperatura. Aumentando-se a temperatura ,o liquido tende a “expulsar” o gás e, consequentemente, a solubilidade do gás diminui.
Aumentando-se a pressão sobre o gás, estaremos, de certo modo, empurrando o gás para dentro do liquido ,o que equivale a dizer que a solubilidade do gás aumenta. Quando o gás não reage com o líquido, a influência da pressão é expressa pela Lei de Henry, que estabelece: em temperatura constante, a solubilidade de um gás em um líquido é diretamente proporcional à pressão do gás.
Lei de Henry
S = k.P, onde k é uma constante de proporcionalidade que depende da natureza do gás e do líquido ,e também, da própria temperatura.
A influência da solubilidade de um gás é utilizada no engarrafamento de refrigerantes. Essas bebidas são engarrafadas sob pressão de CO2. Quando a garrafa é aberta ,a pressão acima do liquido cai, e o excesso de CO2 antes dissolvido, escapa rapidamente , arrastando o liquido e produzindo a espuma que sai pela boca da garrafa.
Uma outra consequência do efeito da pressão na solubilidade de um gás é o doloroso e às, vezes, fatal acidente conhecido como “descompressão”. Isto ocorre quando uma pessoa sobe rapidamente de águas profundas (alta pressão) para a superfície (pressão menor). A rápida descompressão faz com que o ar, dissolvido no sangue e nos outros fluídos do corpo, borbulhe para fora da solução. Essas bolhas impedem a circulação do sangue e afetam os impulsos nervosos.
Nenhum comentário:
Postar um comentário